👩🔬 簡介
鍾筱菁老師實驗室長期專注在感染免疫與細菌致病機轉的研究,並致力於深入探討宿主與病原體之間的交互作用,特別是在嚴重感染導致全身性致命疾病的過程中,宿主因子如何參與調控細菌的毒力表現與免疫反應的動態變化。我們的研究目標是從分子與細胞層次理解這些交互作用的關鍵路徑,進而找出可用於疾病預防與治療的新穎靶點。
目前研究的重點主要聚焦於幾個核心主題,主要探討嗜中性胞外網狀結構(Neutrophil Extracellular Traps, NETs)、細菌胞外DNA以及細菌膜囊泡(vesicle)在細菌生物膜形成與免疫調節的功能。我們結合免疫學、微生物學、分子生物學與先進影像技術,進行跨領域合作與多層次的實驗設計。
本實驗室期望透過系統性研究,不僅加深對感染性疾病發病機轉的理解,更能為未來抗菌療法的開發提供堅實的科學基礎,進而改善臨床治療成效與公共健康防治策略。我們歡迎對免疫與感染有熱忱的研究人員共同加入,探索免疫系統與病原體之間的精彩對話。

學歷
經歷
🔬 研究方向
- Ongoing research projects include:
- I. The immunopathogenesis of infective endocarditis (IE).
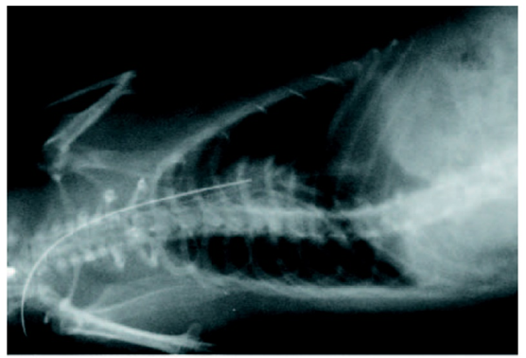
- Fig. 1 The experimental rat model of infective endocarditis
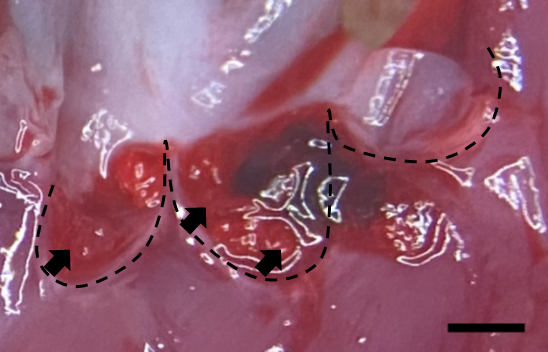
- Fig. 2 The hypothetical model of bacterial colonization on damaged valve in IE
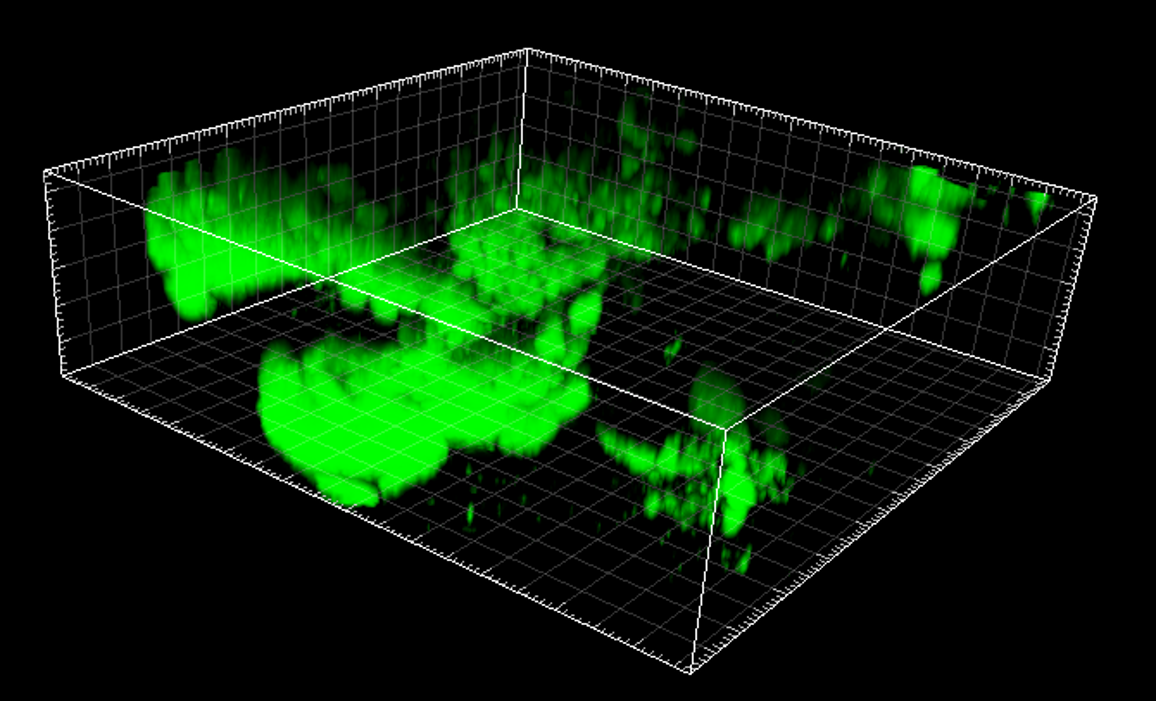
- Fig. 3 The role of NETs in the vegetation maturation in IE
- Fig. 4 The role of AtlA-mediated eDNA and membrane release in biofilm formation in IE
- Fig. 5 The hypothetical mechanisms of eDNA release in S. mutans-induced IE
- II. The roles of oral streptococci in anti-dsDNA antibody production
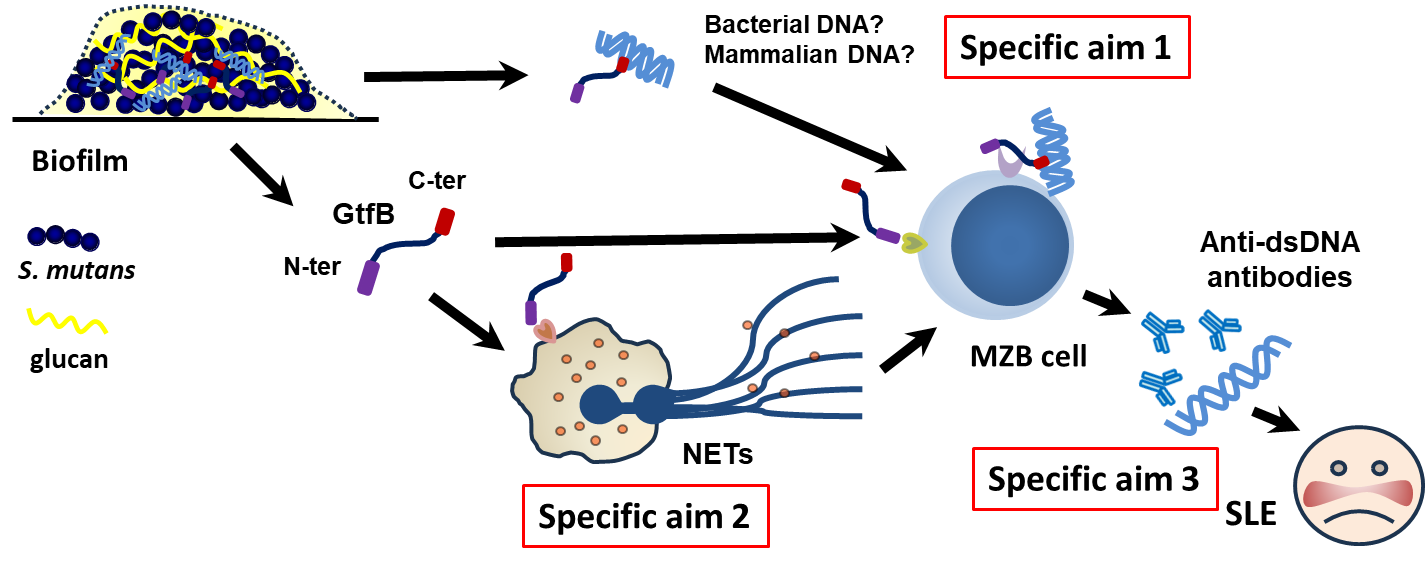
- Fig. 6 The hypothetical mechanism of Gtf-induced anti-dsDNA antibody production
- III. The roles of NETs in other infectious diseases
- 1) Cutibacterium acnes-induced acne vulgaris (in collaboration with Dr. Shi, Shuang Ho Hospital)
- 2) NETs-associated thrombosis in catheter-related central venous stenosis (In collaboration with Dr. Chen, National Taiwan University Hospital)
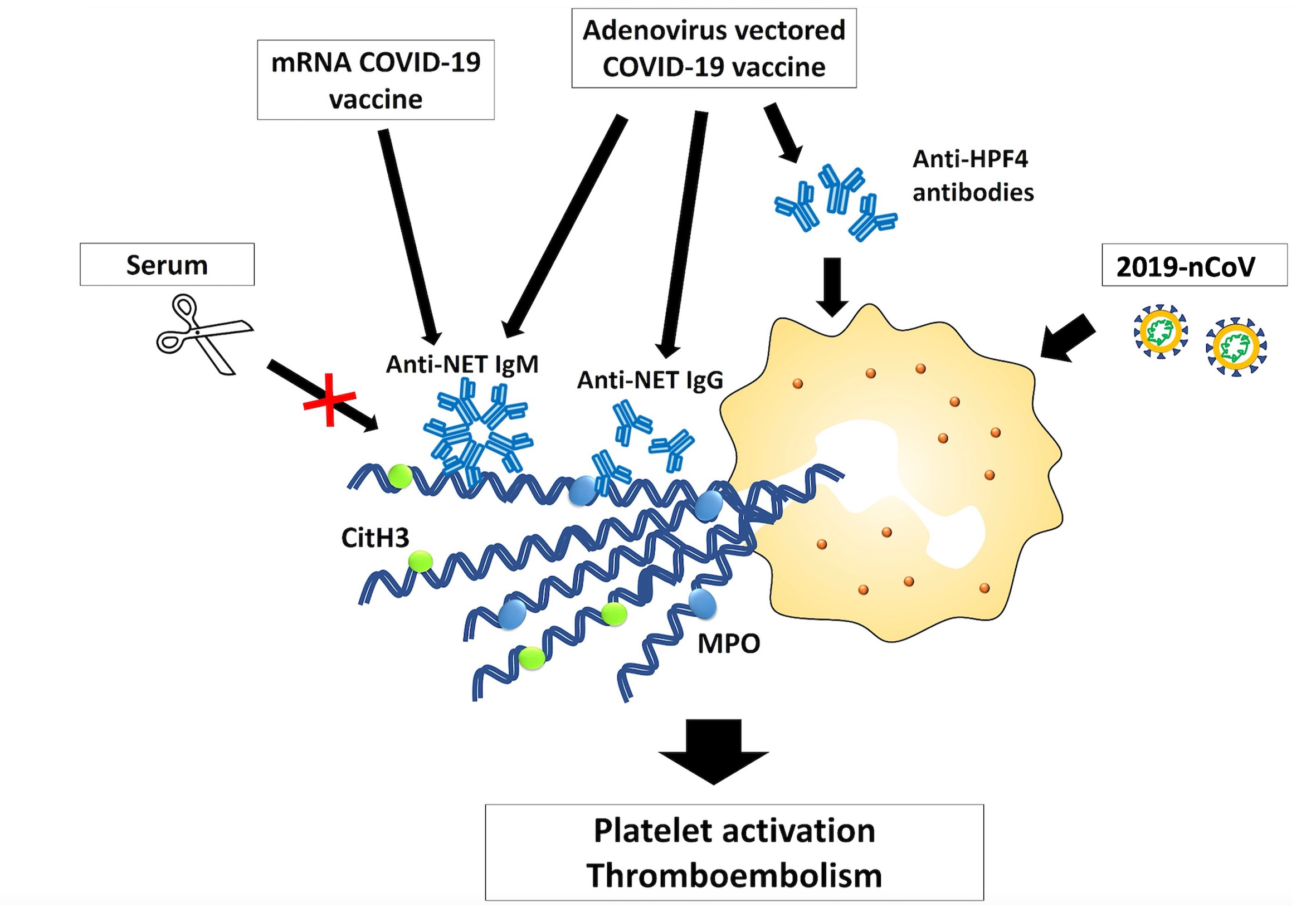
- 3) The role of NETs in vaccine-induced adverse events (AEs) (In collaboration with Dr. Kuo, National Taiwan University Hospital)
- IV. The mechanisms of bacterial antibiotic resistance and identification of alternative therapeutic agents
- 1) Membrane vesicles in the treatment of daptomycin-resistant enterococci (In collaboration with Dr. Chung, National Taiwan University Hospital, and Dr. Hsu, Soochow University)
- Fig. 8 Daptomycin treatment enhances MV production of VRE
- Fig. 9 MVs enhance bacterial resistance against daptomycin treatment
- 2) Identification of antimicrobial peptides against MRAB and MRKP(In collaboration with Dr. Chung, National Taiwan University Hospital, and Dr. Fan, Taipei Medical University)
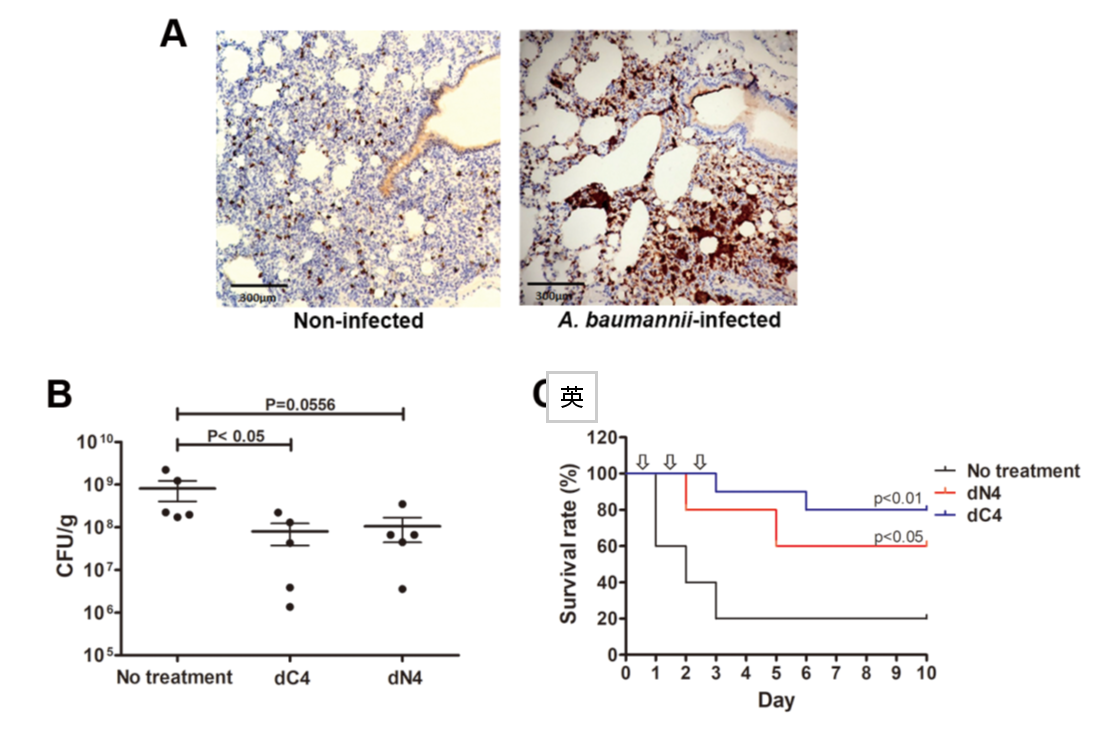
- Fig. 10 AMP dN4 and dC4 exhibit antimicrobial activity in MRAB-induced pneumoniae mouse model.
Host factors play a critical role in regulating bacterial virulence and the progression of systemic lethal diseases. Consequently, targeting the interactions between bacteria and the host represents a promising strategy for developing effective therapies against these infections. The long-term goal of my research is to investigate host-pathogen interactions to uncover novel approaches for managing infectious diseases. In particular, We focus on the roles of neutrophil extracellular traps (NETs), bacterial extracellular DNA, and bacterial membrane vesicles in bacterial pathogenesis. In addition, we investigate the mechanisms underlying bacterial antibiotic resistance and explore alternative agents against antibiotic-resistant pathogens, including vancomycin-resistant enterococci, multidrug-resistant Acinetobacter baumannii, and multidrug-resistant Klebsiella pneumoniae.
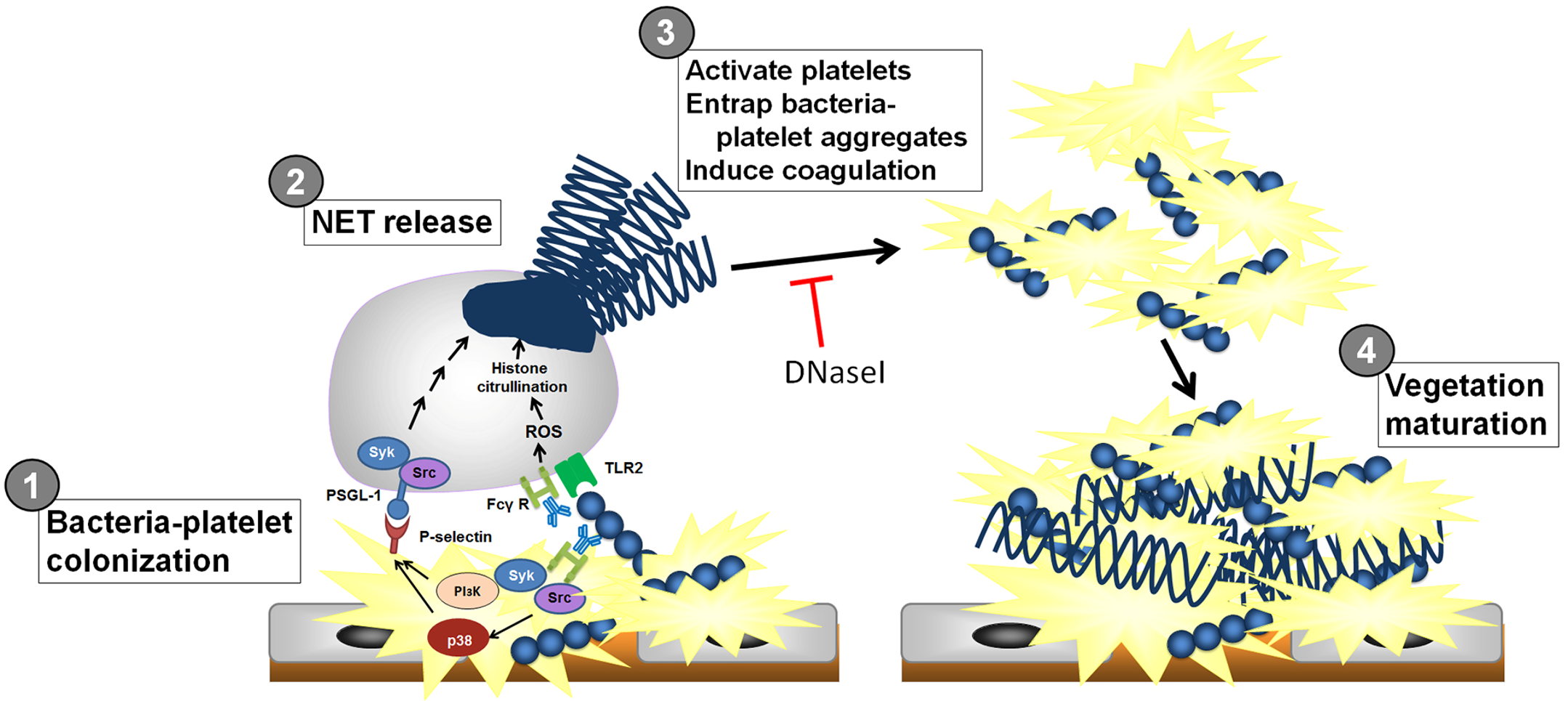
Infective endocarditis (IE) is a prototypical biofilm-associated infectious disease of the cardiovascular system, characterized by a high mortality rate (Fig. 1). Clinical management of IE still relies on prolonged administration of high-dose antibiotics and is often complicated by frequent recurrence. My research has demonstrated that host factors significantly enhance the virulence of IE pathogens. For instance, platelets contribute to biofilm formation and antibiotic resistance in IE pathogens (Fig. 2). Furthermore, aggregates formed between bacteria and platelets stimulate infiltrating neutrophils to release neutrophil extracellular traps (NETs), which in turn activate additional platelets and promote thrombus formation. This cascade contributes to the expansion and maturation of IE vegetations (Fig. 3).
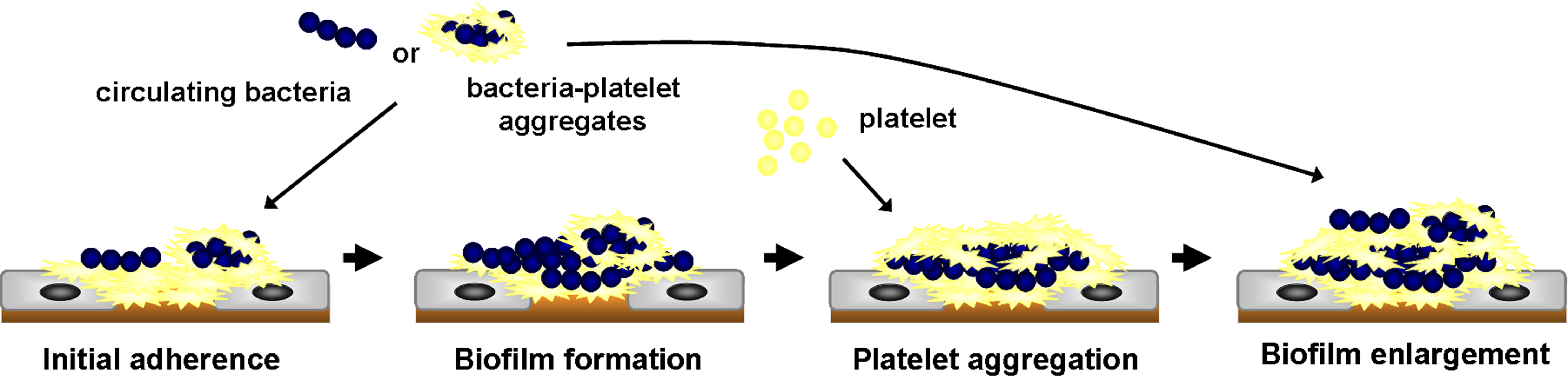
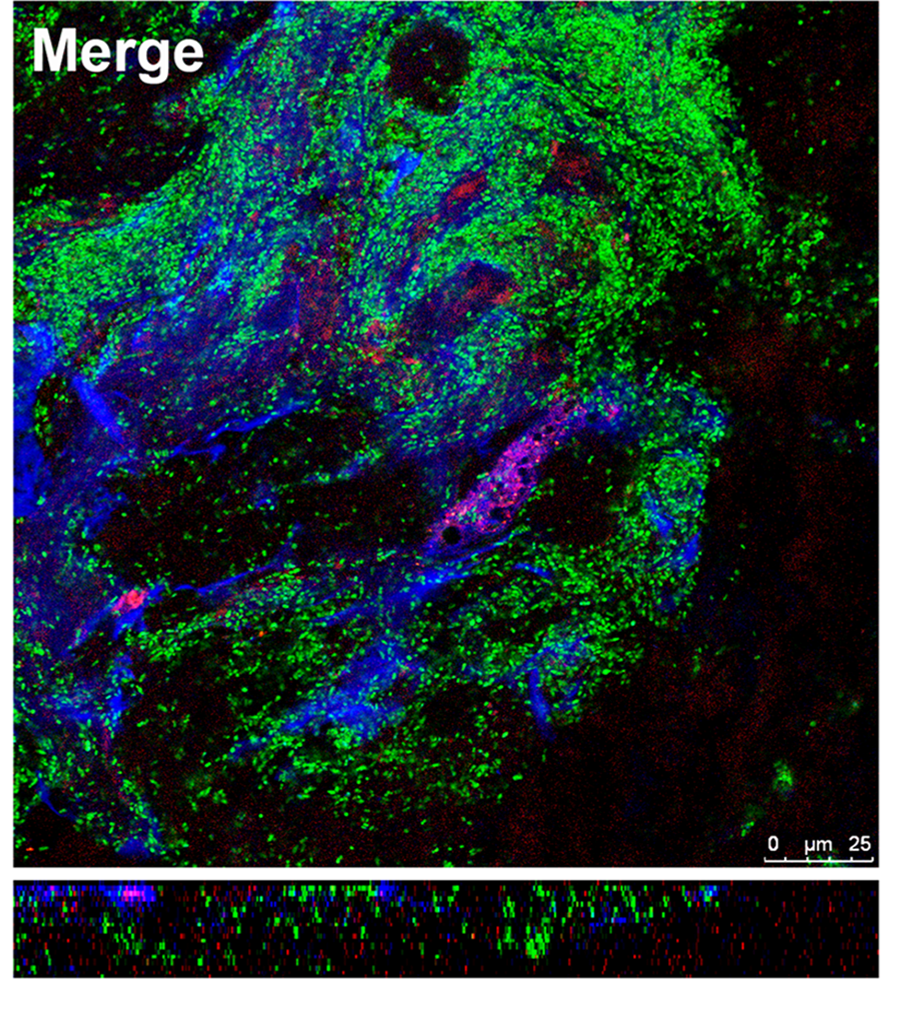
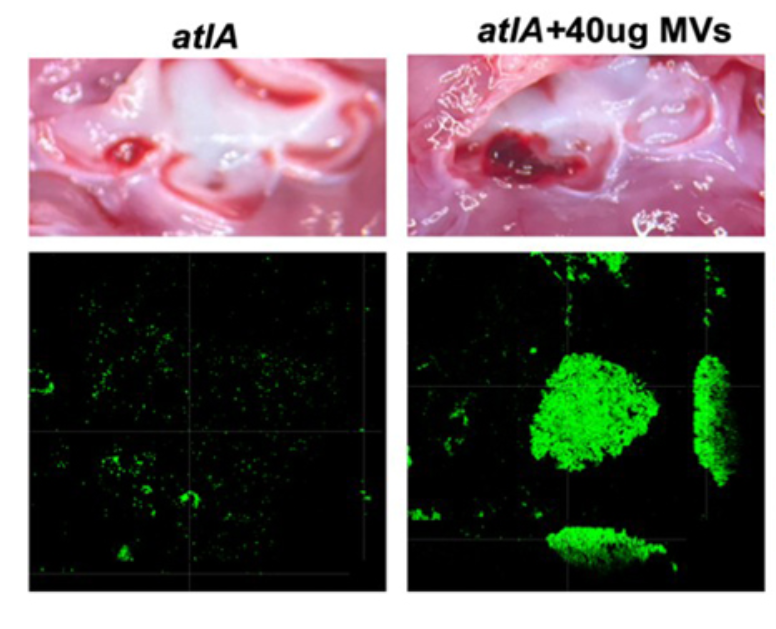
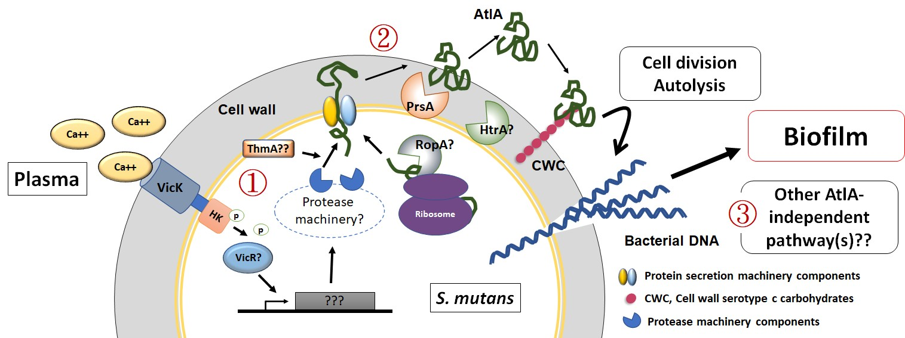
We further demonstrated the critical roles of autolysin (AtlA)-mediated extracellular DNA (eDNA) release and membrane vesicle production in biofilm formation in IE (Fig. 4). In addition, we identified key bacterial virulence factors, including LiaR, PCP, and PrsA, that contribute to eDNA release and membrane vesicle production, both of which promote bacterial biofilm formation in vivo. The underlying molecular mechanisms by which these factors regulate biofilm development will be further investigated (Fig. 5).

Infections are known risk factors for the development of autoimmune diseases. Anti-DNA antibodies, for example, are a key diagnostic marker for systemic lupus erythematosus (SLE) and are thought to contribute to disease pathology. Neutrophil extracellular traps (NETs) are considered a primary source of extracellular DNA and other autoantigens that may trigger autoimmune responses. Our preliminary data show that intravenous infection with oral streptococci or glucosyltransferase (Gtf) leads to the production of anti-DNA antibodies. We hypothesize that oral streptococci within dental biofilms release Gtf, which either binds to extracellular DNA or induces NET formation, thereby promoting anti-dsDNA antibody production and contributing to autoimmune pathogenesis. The underlying mechanisms will be further investigated.
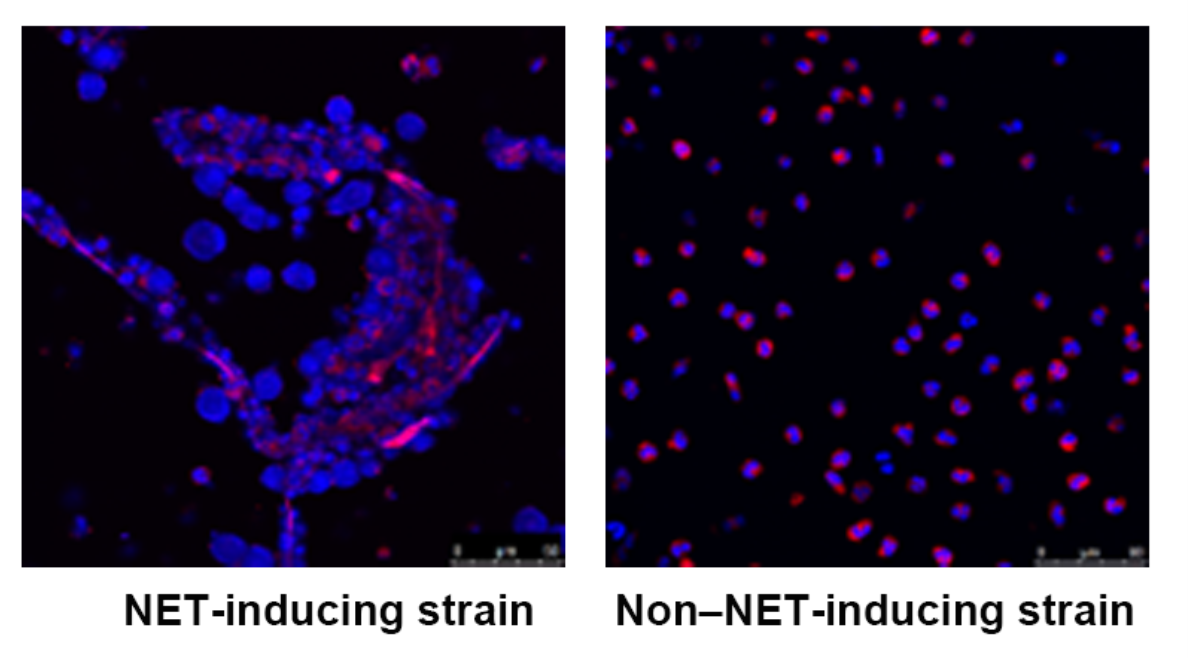
We also investigate the role of neutrophil extracellular traps (NETs) in other infectious diseases in collaboration with clinical physicians.
We collect clinical isolates of C. acnes and examine their NET-inducing potential to understand their role in the pathogenesis of acne vulgaris.
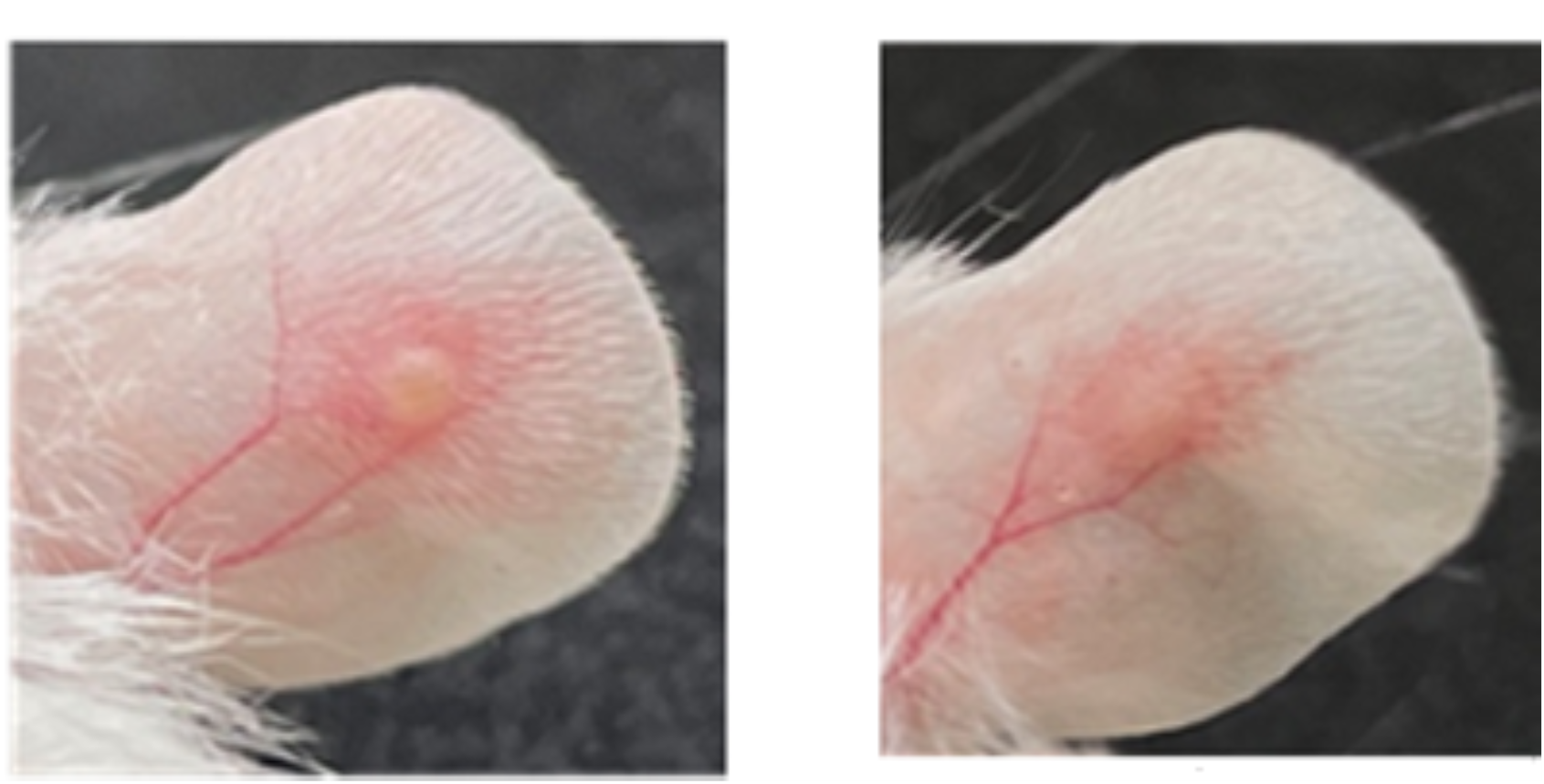
We collect clinical fibrin samples to investigate the role of bacteria-induced NETs in the development of catheter-related central venous stenosis and associated thrombosis.
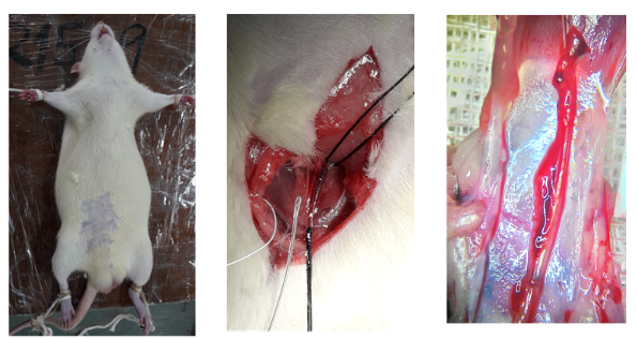
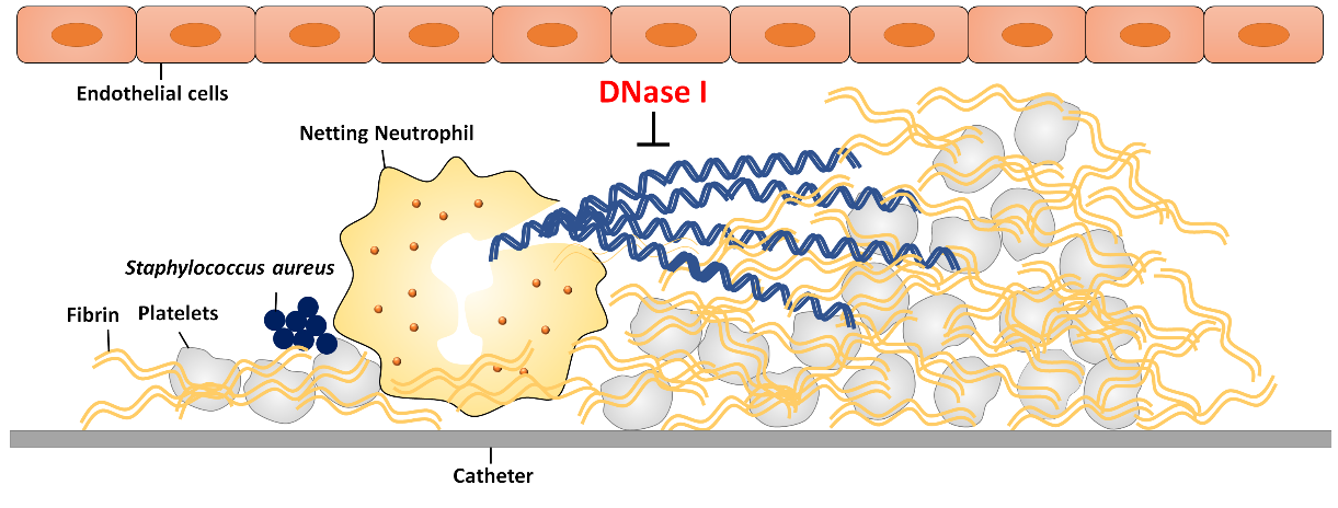
We collect clinical samples to investigate the involvement of NETs in the pathogenesis of vaccine-induced adverse events.
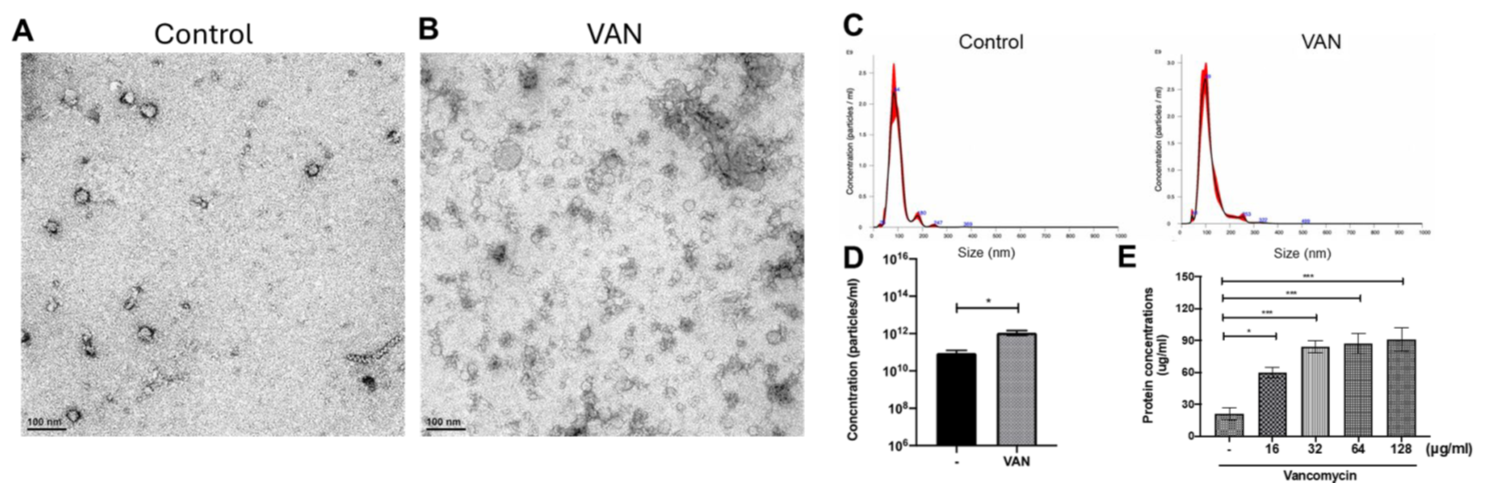
We investigate the mechanisms underlying bacterial antibiotic resistance and explore alternative therapeutic agents targeting antibiotic-resistant pathogens, including vancomycin-resistant enterococci (VRE), multidrug-resistant Acinetobacter baumannii (MRAB), and multidrug-resistant Klebsiella pneumoniae (MRKP).
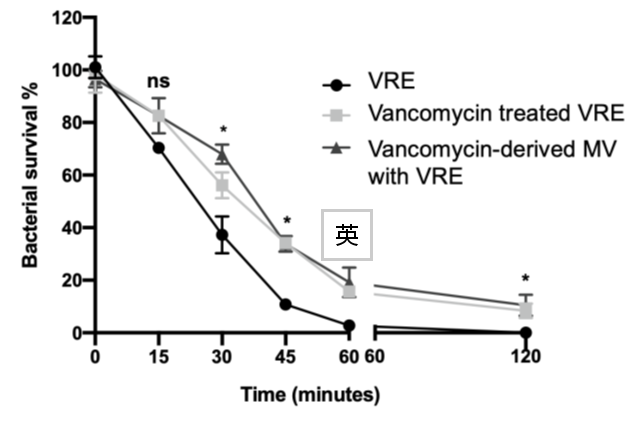
Our previous findings demonstrated that daptomycin treatment enhances MV production in VRE (Fig. 8), and that MVs, in turn, contribute to increased bacterial resistance against daptomycin (Fig. 9). We will continue to elucidate the molecular mechanisms underlying this phenomenon.
To develop alternative antimicrobial strategies against multidrug-resistant bacteria, we are screening antimicrobial peptides (AMPs). Several AMPs have been identified that exhibit potent activity against MRAB and MRKP in vitro and in vivo (Fig. 10). The underlying mechanisms of action and their potential for clinical application will be further investigated.
👥 實驗室成員

- 鍾筱菁 副教授(主持人)
研究助理


研究生






🤝 合作對象

郭佑民 醫師
國立臺灣大學醫學院臨床醫學研究所醫學博士,國立臺灣大學醫學系醫學士。臺大醫院內科部免疫風濕科專任主治醫師、臨床講師,專長於自體免疫疾病及關節炎相關照護。

陳政維 醫師
國立臺灣大學醫學院臨床醫學研究所醫學博士,中國醫藥大學醫學系醫學士。臺大醫院外科部心臟血管外科專任主治醫師、臨床助理教授,專長於成人心臟手術周邊血管手術。

莊名凱 醫師
國立臺灣大學醫學系醫學士。臺大醫院檢驗醫學部專任主治醫師,專長急性骨髓性白血病及血液學檢驗診斷。

施怡賢 醫師
臺北醫學大學醫學科學研究所博士,國立臺灣大學醫學系醫學士。部立雙和醫院皮膚科主任,專長異位性皮膚炎、感染及臨床皮膚治療策略。

許智傑 助理教授
國立臺灣大學口腔生物研究所博士,長庚大學醫學檢驗暨生物技術學系學士。東吳大學微生物學系助理教授,研究重點為鏈球菌致病機轉與抗藥性。
🏆 研究成果與計畫
研究計畫
執行中
- 2023/08 ~ 2026/07:在轉糖鏈球菌引起的心內膜炎致病機轉中細菌胞外去氧核醣核酸相關的生物膜形成的調控及機制探討 - 國家科學及技術委員會
- 2024/08 ~ 2025/07:口腔共生鏈球菌引起嗜中性白血球胞外結構的釋放及透過結構相似引發抗雙股去氧核醣核酸抗體的分子機轉( III ) - 國家科學及技術委員會
已完成
- 2024/01 ~ 2024/12:第七型分泌系統在草綠色鏈球菌引起的感染性心內膜炎中細菌逃避免疫攻擊及生物膜形成所扮演的角色及機制探討 - 校內計畫
- 2023/08 ~ 2024/07:口腔共生鏈球菌引起嗜中性白血球胞外結構的釋放及透過結構相似引發抗雙股去氧核醣核酸抗體的分子機轉(2/3) - 國家科學及技術委員會
- 2023/07 ~ 2024/02:探討轉糖鏈球菌細菌色素在細菌毒力因子與致病機轉中扮演的角色 - 國家科學及技術委員會
- 2022/08 ~ 2023/07:在戈登鏈球菌引起的心內膜炎中參與調控與血小板相關的生物膜形成及抗生素抗藥性的雙分子調控系統及相關機制探討 - 國家科學及技術委員會
- 2022/07 ~ 2023/02:探討細菌色素在轉糖鏈球菌引起血小板凝集、生物膜形成扮演的角色 - 國家科學及技術委員會
- 2022/07 ~ 2023/02:探討戈登鏈球菌VicR調控蛋白質在細菌與血小板交互作用中扮演的角色 - 國家科學及技術委員會
- 2021/08 ~ 2022/07:BSP相似重複序列家族蛋白在草綠色鏈球菌所引起的感染性心內膜炎中細菌逃避免疫攻擊及生物膜形成所扮演的角色及機制探討(3/3) - 國家科學及技術委員會
- 2021/07 ~ 2022/02:探討PrsA蛋白質在草綠色鏈球菌引起感染性心內膜炎扮演的角色 - 國家科學及技術委員會
- 2020/08 ~ 2021/07:BSP相似重複序列家族蛋白在草綠色鏈球菌所引起的感染性心內膜炎中細菌逃避免疫攻擊及生物膜形成所扮演的角色及機制探討(2/3) - 國家科學及技術委員會
- 2020/07 ~ 2021/02:ARP-42 蛋白在轉糖鏈球菌抗吞噬作用及生物膜形成中扮演的角色 - 國家科學及技術委員會
- 2019/08 ~ 2020/07:BSP相似重複序列家族蛋白在草綠色鏈球菌所引起的感染性心內膜炎中細菌逃避免疫攻擊及生物膜形成所扮演的角色及機制探討(1/3) - 國家科學及技術委員會
- 2018/08 ~ 2019/07:轉糖鏈球菌自體溶解素的調控系統在感染性心內膜炎中細菌存活及生物膜形成所扮演的角色(2/2) - 國家科學及技術委員會
- 2017/08 ~ 2018/07:轉糖鏈球菌自體溶解素的調控系統在感染性心內膜炎中細菌存活及生物膜形成所扮演的角色(1/2) - 國家科學及技術委員會
- 2017/04 ~ 2018/03:新聘教師研究補助 - 新聘教師研究補助
期刊、論文發表
📍 聯絡方式
地址:臺北市信義區吳興街250號
臺北醫學大學 醫學院 醫學系 微生物暨免疫學科 / 醫學科學研究所
電話:02-2736-1661 # 27101
電子郵件:cjjung@tmu.edu.tw



